تأیید شتابیافته FDA برای داروی zongertinib ؛ امید تازه بیماران مبتلا به سرطان ریه
تاریخ انتشار :
شنبه ۱۸ مرداد ۱۴۰۴ ساعت ۱۴:۲۳
کد مطلب : ۱۹۴۶۹
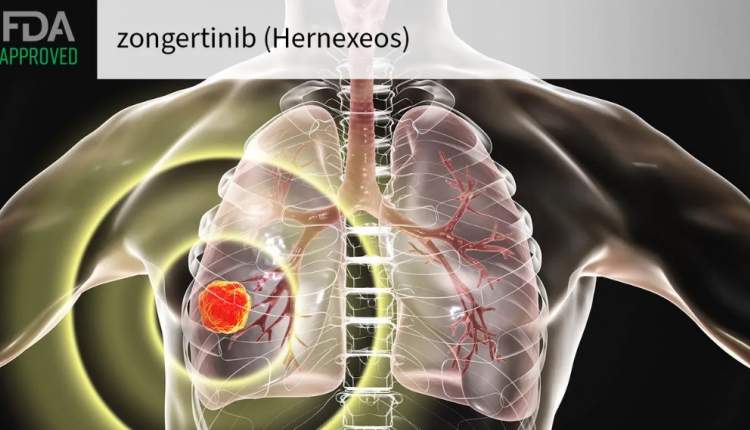
سالمخبر: سازمان غذا و داروی آمریکا FDA روز جمعه مجوز تأیید شتابیافته داروی زونگرتینیب (Hernexeos) را برای درمان بیماران مبتلا به سرطان ریه غیرسلول کوچک (NSCLC) غیرسنگفرشی دارای جهش فعالکننده در ناحیه تیروزینکیناز HER2 صادر کرد.
به گزارش سالمخبر به نقل از مدپیج تودی، این تأییدیه شامل بیماران بزرگسال مبتلا به بیماری غیرقابل جراحی یا متاستاتیک است که قبلاً یک خط درمان سیستمیک دریافت کردهاند. مبنای این تصمیم، نتایج مطالعه بالینی Beamion LUNG-1 در فاز Ia/Ib بود.
در این مطالعه، ۷۱ بیمار که پیشتر شیمیدرمانی مبتنی بر پلاتین دریافت کرده ولی هیچگونه درمان هدفمند HER2 یا ADC دریافت نکرده بودند، تحت درمان با زونگرتینیب قرار گرفتند. نرخ پاسخ عینی (ORR) در این گروه ۷۵ درصد بود و ۵۸ درصد پاسخها بیش از ۶ ماه دوام داشت.
در گروه دیگر شامل ۳۴ بیمار که علاوه بر شیمیدرمانی مبتنی بر پلاتین، یک ADC هدفمند HER2 دریافت کرده بودند، نرخ پاسخ عینی ۴۴ درصد و پاسخهای پایدار بیش از ۶ ماه در ۲۷ درصد بیماران مشاهده شد.
جان هیمک از مرکز سرطان MD Anderson در تگزاس گفت: «با تأیید زونگرتینیب، یک گزینه درمانی خوراکی، هدفمند و مؤثر برای بیماران مبتلا به NSCLC با جهش HER2 در ایالات متحده فراهم شده که نهتنها پاسخ پایدار ایجاد میکند بلکه از نظر ایمنی نیز قابلمدیریت است.»
وی افزود: این دارو برای جمعیتی از بیماران که گزینههای درمانی محدودی دارند، پیشرفت مهمی در درمان سرطان محسوب میشود. ادامه تأیید این دارو به نتایج کارآزمایی تأییدی وابسته خواهد بود.
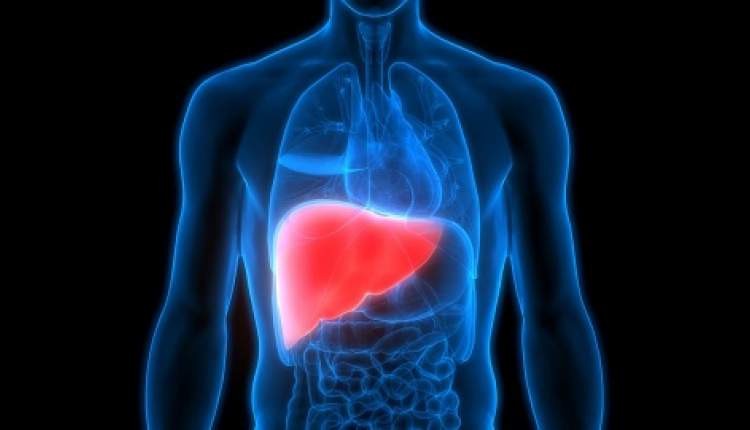
عوارض شایع در جمعیت ایمنی شامل اسهال (۵۳٪)، سمیت کبدی (۲۷٪)، بثورات پوستی (۲۷٪)، خستگی (۲۲٪) و تهوع (۲۱٪) بود. میزان قطع درمان بهدلیل عوارض تنها ۲.۹٪ گزارش شد.
اطلاعات نسخه دارو هشدارهایی درباره خطر سمیت کبدی، اختلال عملکرد بطن چپ، بیماری بینابینی ریه/پنومونیت و سمیت جنینی دارد.
همچنین، تست تشخیصی Oncomine Dx Target Test بهعنوان ابزار همراه برای شناسایی جهشهای فعالکننده HER2 TKD در بیماران NSCLC غیرسنگفرشی تأیید شد تا شایستگی آنان برای درمان با زونگرتینیب مشخص شود.
به گزارش سالمخبر به نقل از مدپیج تودی، این تأییدیه شامل بیماران بزرگسال مبتلا به بیماری غیرقابل جراحی یا متاستاتیک است که قبلاً یک خط درمان سیستمیک دریافت کردهاند. مبنای این تصمیم، نتایج مطالعه بالینی Beamion LUNG-1 در فاز Ia/Ib بود.
در این مطالعه، ۷۱ بیمار که پیشتر شیمیدرمانی مبتنی بر پلاتین دریافت کرده ولی هیچگونه درمان هدفمند HER2 یا ADC دریافت نکرده بودند، تحت درمان با زونگرتینیب قرار گرفتند. نرخ پاسخ عینی (ORR) در این گروه ۷۵ درصد بود و ۵۸ درصد پاسخها بیش از ۶ ماه دوام داشت.
در گروه دیگر شامل ۳۴ بیمار که علاوه بر شیمیدرمانی مبتنی بر پلاتین، یک ADC هدفمند HER2 دریافت کرده بودند، نرخ پاسخ عینی ۴۴ درصد و پاسخهای پایدار بیش از ۶ ماه در ۲۷ درصد بیماران مشاهده شد.
جان
وی افزود: این دارو برای جمعیتی از بیماران که گزینههای درمانی محدودی دارند، پیشرفت مهمی در درمان سرطان محسوب میشود. ادامه تأیید این دارو به نتایج کارآزمایی تأییدی وابسته خواهد بود.
عوارض شایع در جمعیت ایمنی شامل اسهال (۵۳٪)، سمیت کبدی (۲۷٪)، بثورات پوستی (۲۷٪)، خستگی (۲۲٪) و تهوع (۲۱٪) بود. میزان قطع درمان بهدلیل عوارض تنها ۲.۹٪ گزارش شد.
اطلاعات نسخه دارو هشدارهایی درباره خطر سمیت کبدی، اختلال عملکرد بطن چپ، بیماری بینابینی ریه/پنومونیت و سمیت جنینی دارد.
همچنین، تست تشخیصی Oncomine Dx Target Test بهعنوان ابزار همراه برای شناسایی جهشهای فعالکننده HER2 TKD در بیماران NSCLC غیرسنگفرشی تأیید شد تا شایستگی آنان برای درمان با زونگرتینیب مشخص شود.