داروی جدید کوتاهقامتی کودکان TransCon CNP در انتظار تصمیم نهایی FDA
تاریخ انتشار :
پنجشنبه ۶ آذر ۱۴۰۴ ساعت ۱۵:۱۱
کد مطلب : ۲۰۲۸۷
سالمخبر: سازمان غذا و داروی آمریکا FDA اعلام کرد: روند بررسی داروی جدید شرکت Ascendis Pharma برای درمان یکی از نادرترین اختلالات ژنتیکی رشد در کودکان را سه ماه دیگر تمدید کرده است؛ تصمیمی که نشان میدهد نهاد تنظیمگر به اطلاعات بیشتری درباره مطالعه تکمیلی این دارو نیاز دارد. به گفته این شرکت دانمارکی، مهلت تازه FDA تا ۲۸ فوریه ۲۰۲۶ تعیین شده است.
به گزارش سالمخبر به نقل از رویترز، این تأخیر پس از آن رخ داد که Ascendis در ۵ نوامبر ۲۰۲۵ اطلاعات اضافی مربوط به مطالعه پیگیری اجباری دارو را ارائه کرد؛ اطلاعاتی که به گفته FDA «تغییری اساسی در پرونده درخواست تأیید» ایجاد کرده است. مجموعه پرسشهای باقیمانده از سوی FDA نیز از سوی شرکت پاسخ داده شده و نسخه بازنگریشده طرح مطالعه پس از تأیید اولیه ارائه شده است.
یان میکلسن، مدیرعامل Ascendis، اعلام کرده که شرکت همچنان در تعامل نزدیک با FDA باقی خواهد ماند تا الزامات نهایی تأیید را به سرانجام برساند. او تأکید کرده است که ارائه اطلاعات تکمیلی، بخشی از فرآیند طبیعی تأیید داروهای نوآورانه در حوزه بیماریهای نادر است و Ascendis بهطور کامل با سازمان غذا و دارو همکاری خواهد کرد.
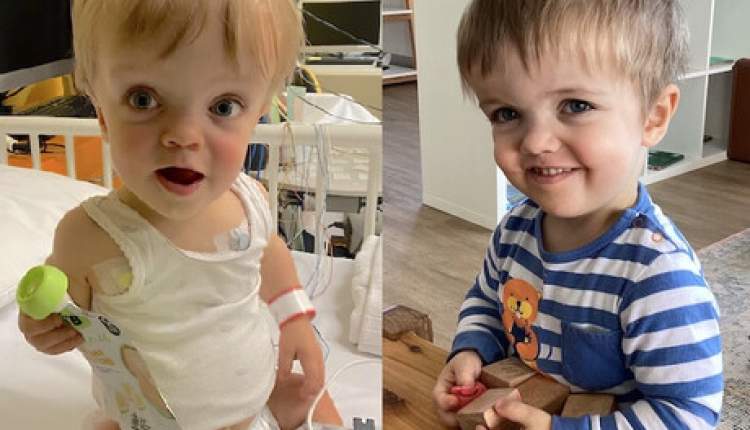
داروی مورد بررسی TransCon CNP، برای درمان آکندروپلازی (Achondroplasia) توسعه یافته است؛ اختلالی ژنتیکی که بهعلت جهش در ژن FGFR3 ایجاد میشود و رشد استخوانها را محدود کرده و منجر به کوتولهگی میشود. این بیماری با وجود شیوع نسبی کم، یکی از شناختهشدهترین اختلالات رشد کودکان در جهان است و درمان مؤثر آن، نیاز بالینی برآوردهنشده محسوب میشود.
TransCon CNP بر پایه هورمون طبیعی پپتید ناتریورتیک نوع C (CNP) طراحی شده که برخلاف اثر مهارکننده FGFR3، مسیرهای رشد استخوانی را فعال میکند. دادههای اولیه مطالعات قبلی نشان دادهاند که این درمان میتواند رشد طولی استخوان را در کودکان مبتلا افزایش دهد و سرعت رشد را بهتدریج به سطح نزدیکتری از کودکان سالم برساند.
بهگفته تحلیلگران، هرچند تمدید بررسی بهمعنای تأخیر در زمانبندی عرضه احتمالی دارو است، اما معمولاً در حوزه بیماریهای نادر و ژندرمانیها امری رایج محسوب میشود و نمیتواند شاخصی از احتمال رد شدن دارو باشد؛ بهویژه زمانی که شرکت اعلام میکند به تمامی پرسشهای FDA پاسخ داده است.
به گزارش سالمخبر به نقل از رویترز، این تأخیر پس از آن رخ داد که Ascendis در ۵ نوامبر ۲۰۲۵ اطلاعات اضافی مربوط به مطالعه پیگیری اجباری دارو را ارائه کرد؛ اطلاعاتی که به گفته FDA «تغییری اساسی در پرونده درخواست تأیید» ایجاد کرده است. مجموعه پرسشهای باقیمانده از سوی FDA نیز از سوی شرکت پاسخ داده شده و نسخه بازنگریشده
یان میکلسن، مدیرعامل Ascendis، اعلام کرده که شرکت همچنان در تعامل نزدیک با FDA باقی خواهد ماند تا الزامات نهایی تأیید را به سرانجام برساند. او تأکید کرده است که ارائه اطلاعات تکمیلی، بخشی از فرآیند طبیعی تأیید داروهای نوآورانه در حوزه بیماریهای نادر است و Ascendis بهطور کامل با سازمان غذا و دارو همکاری خواهد کرد.
داروی مورد بررسی TransCon CNP، برای درمان آکندروپلازی (Achondroplasia) توسعه یافته است؛ اختلالی ژنتیکی که بهعلت جهش در ژن FGFR3 ایجاد میشود و رشد استخوانها را محدود کرده و منجر به کوتولهگی میشود. این بیماری با وجود شیوع نسبی کم، یکی از شناختهشدهترین اختلالات رشد کودکان در جهان است و درمان مؤثر آن، نیاز بالینی
TransCon CNP بر پایه هورمون طبیعی پپتید ناتریورتیک نوع C (CNP) طراحی شده که برخلاف اثر مهارکننده FGFR3، مسیرهای رشد استخوانی را فعال میکند. دادههای اولیه مطالعات قبلی نشان دادهاند که این درمان میتواند رشد طولی استخوان را در کودکان مبتلا افزایش دهد و سرعت رشد را بهتدریج به سطح نزدیکتری از کودکان سالم برساند.
بهگفته تحلیلگران، هرچند تمدید بررسی بهمعنای تأخیر در زمانبندی عرضه احتمالی دارو است، اما معمولاً در حوزه بیماریهای نادر و ژندرمانیها امری رایج محسوب میشود و نمیتواند شاخصی از احتمال رد شدن دارو باشد؛ بهویژه زمانی که شرکت اعلام میکند به تمامی پرسشهای FDA پاسخ داده است.